一种被称为“线粒体自噬”的过程负责去除线粒体,线粒体是细胞的能量产生部分。如果它们有缺陷,或者为了调节它们的数量,就会发生这种情况。一种锚定在线粒体表面的蛋白质称为 Atg32,当它与另一种蛋白质 Atg11 相互作用时会促进这一过程。通过“磷酸化”(磷酸基团的连接)对 Atg32 的修饰稳定了 Atg32 和 Atg11 之间的相互作用。调节这种磷酸化的过程是未知的,但现在大阪大学的一个小组表明,有效的线粒体自噬需要一个称为 GET 通路的系统。
线粒体自噬需要 Atg32 的磷酸化以及 Atg32 和 Atg11 蛋白之间的稳定相互作用。称为 Ppg1–Far 复合物的蛋白质复合物的作用会抑制线粒体自噬。这会减少 Atg32 磷酸化和与 Atg11 的相互作用,从而抑制线粒体自噬。
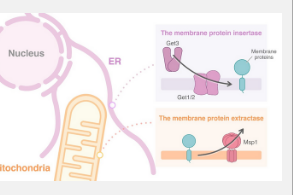
位于细胞内膜中的蛋白质必须靶向其适当的目的地,以维持不同细胞区室的功能。GET 通路负责将膜蛋白插入内质网,内质网是细胞内连续且动态的膜系统。当这条通路被破坏时,蛋白质可以主要插入线粒体外膜。
该团队首先发现缺乏 GET 通路的细胞表现出线粒体自噬减少。“当细胞缺乏 GET 通路和 Ppg1-Far 复合物时,这种表型得以挽救,”第一作者 Mashun Onishi 解释说,“这表明我们观察到的线粒体自噬减少与 Ppg1-Far 复合物的活性有关。”
“然后我们继续证明 GET 通路负责将 Ppg1-Far 复合物束缚在内质网膜上,”资深作者 Koji Okamoto 解释说,“阻止它与 Atg32 相互作用以抑制线粒体自噬,从而允许 Atg32 激活和随之而来的与 Atg11 的互动。” 然而,在没有 GET 通路的情况下,Ppg1–Far 复合物反而靶向线粒体外膜,在那里它起到抑制线粒体自噬过程的作用。
一种叫做 Msp1 的蛋白质可以从位于那里的线粒体膜上去除非线粒体蛋白质。该团队发现 GET 和 Msp1 的破坏会导致更严重的线粒体自噬缺陷。这表明 Msp1 可能负责从线粒体中错误地过度定位 Ppg1–Far,从而维持所需的线粒体自噬水平。
线粒体自噬过程中的缺陷可导致细胞死亡,并与衰老和阿尔茨海默病有关。这项工作极大地增加了我们对线粒体自噬的理解,并为未来对人类健康产生重大影响的研究开辟了道路。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
